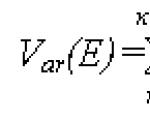สมบัติทางเคมีของโลหะ การกัดกร่อนของโลหะ “คุณสมบัติทั่วไปของโลหะ โลหะ. เซมิคอนดักเตอร์ อิเล็กทริก ทฤษฎีวงดนตรี
คุณสมบัติทางเคมี ได้แก่ ความสามารถของโลหะในการต้านทานการเกิดออกซิเดชันหรือเข้าไปในสารประกอบที่มีสารต่างๆ: ออกซิเจนในบรรยากาศ ความชื้น (โลหะเมื่อรวมกับออกซิเจนและน้ำจะเกิดเป็นเบส (ด่าง)) คาร์บอนไดออกไซด์ ฯลฯ ยิ่งโลหะผสมกับองค์ประกอบอื่นได้ดีเท่าไรก็ยิ่งแตกหักง่ายเท่านั้น เรียกว่าการทำลายทางเคมีของโลหะภายใต้อิทธิพลของสภาพแวดล้อมที่อุณหภูมิปกติ การกัดกร่อนของโลหะ .
คุณสมบัติทางเคมีของโลหะรวมถึงความสามารถในการสร้างตะกรันเมื่อถูกความร้อนในบรรยากาศออกซิไดซ์รวมถึงการละลายในของเหลวที่มีฤทธิ์ทางเคมีหลายชนิด: กรด, ด่าง ฯลฯ โลหะที่ทนทานต่อการเกิดออกซิเดชันเมื่อสัมผัสกับความร้อนสูงเรียกว่า ทนความร้อน (ทนต่อตะกรัน)
ความสามารถของโลหะในการรักษาโครงสร้างไว้ที่อุณหภูมิสูงและไม่ทำให้อ่อนตัวหรือเสียรูปภายใต้ภาระเรียกว่า ทนความร้อน
ความต้านทานของโลหะต่อการกัดกร่อน ตะกรัน และการละลายถูกกำหนดโดยการเปลี่ยนแปลงน้ำหนักของตัวอย่างทดสอบต่อหน่วยพื้นผิวต่อหน่วยเวลา
การกัดกร่อนของโลหะ - คำว่า "การกัดกร่อน" (ในภาษาละติน "การกัดกร่อน") มักใช้เพื่อระบุปรากฏการณ์ที่รู้จักกันดี ได้แก่ การเกิดสนิมของเหล็ก การเคลือบทองแดงด้วยชั้นออกไซด์สีเขียว และการเปลี่ยนแปลงที่คล้ายกันในโลหะ
อันเป็นผลมาจากการกัดกร่อน โลหะจะถูกทำลายบางส่วนหรือทั้งหมด คุณภาพของผลิตภัณฑ์ลดลง และอาจไม่เหมาะสมต่อการใช้งาน
โลหะส่วนใหญ่พบในธรรมชาติในรูปของสารประกอบที่มีองค์ประกอบอื่น ๆ เช่นเหล็ก - ในรูปของ Fe 2 O 3, Fe 3 O 4, FeCO 3, ทองแดง - ในรูปของ CuFeS 2, Cu 2 S, อลูมิเนียม - ในรูปของ Al 2 O 3 เป็นต้น อันเป็นผลมาจากกระบวนการทางโลหะวิทยา การเชื่อมต่อระหว่างโลหะกับสารที่มีอยู่ในสภาพธรรมชาติอย่างมั่นคงหยุดชะงัก แต่จะได้รับการฟื้นฟูภายใต้เงื่อนไขของการรวมกันของโลหะกับออกซิเจนและองค์ประกอบอื่น ๆ นี่คือสาเหตุของการกัดกร่อน
การพัฒนาทฤษฎีการกัดกร่อนเป็นข้อดีของนักวิทยาศาสตร์ชาวรัสเซีย V.A.Kistyakovsky, G.V.Akimov, N.A.Izgaryshev และคนอื่น ๆ ตามที่นักวิจัยเกี่ยวกับปรากฏการณ์การกัดกร่อน การกัดกร่อนมีสองประเภท: การกัดกร่อนทางเคมีไฟฟ้าและการกัดกร่อนทางเคมี
การกัดกร่อนด้วยไฟฟ้าเคมี (รูปที่ 13.) คือกระบวนการทำลายโลหะที่สัมผัสกับของเหลวที่นำกระแสไฟฟ้า (อิเล็กโทรไลต์) เช่น ด้วยกรด ด่าง สารละลายเกลือในน้ำ น้ำที่มีอากาศละลายอยู่ ปรากฏการณ์ที่เกิดขึ้นที่นี่คล้ายคลึงกับปรากฏการณ์ที่สามารถสังเกตได้ในเซลล์กัลวานิก ตัวอย่างเช่น ในเหล็กกล้า ธาตุกัลวานิกจะเกิดเป็นเหล็กคาร์ไบด์และเฟอร์ไรต์ ในอิเล็กโทรไลต์ คาร์ไบด์ยังคงไม่เปลี่ยนแปลง แต่เฟอร์ไรต์จะละลายและทำให้เกิดสนิมด้วยสารอิเล็กโทรไลต์ ซึ่งเป็นผลิตภัณฑ์ที่มีฤทธิ์กัดกร่อน
พฤติกรรมของโลหะหลายชนิดในอิเล็กโทรไลต์สามารถตัดสินได้จากตำแหน่งในชุดแรงดันไฟฟ้า: โพแทสเซียม, แคลเซียม, แมกนีเซียม, อลูมิเนียม, แมงกานีส, สังกะสี, โครเมียม, เหล็ก, แคดเมียม, โคบอลต์, นิกเกิล, ดีบุก, ตะกั่ว, ไฮโดรเจน, พลวง, บิสมัท, ทองแดง ปรอท เงิน ทอง
ในชุดที่กำหนด โลหะจะถูกจัดเรียงตามค่าของศักย์ไฟฟ้าปกติ (เช่น ได้จากการจุ่มโลหะในสารละลายเกลือปกติ) เทียบกับไฮโดรเจน โลหะแต่ละชนิดในแถวนี้จับคู่กับอิเล็กโทรไลต์อีกชนิดจะก่อตัวเป็นเซลล์กัลวานิก และโลหะที่อยู่ด้านซ้ายของแถวจะถูกทำลาย ดังนั้นในคู่ทองแดง-สังกะสี สังกะสีจึงถูกทำลาย ชุดแรงดันไฟฟ้ามีความสำคัญในทางปฏิบัติอย่างมาก: บ่งบอกถึงอันตรายจากการวางโลหะที่ไม่เหมือนกันในการสัมผัสโดยตรง เนื่องจากสิ่งนี้จะสร้างเงื่อนไขสำหรับการก่อตัวขององค์ประกอบกัลวานิกและการทำลายของโลหะตัวใดตัวหนึ่งที่อยู่ทางด้านซ้ายในชุดของ แรงดันไฟฟ้า
มะเดื่อ 13. แผนภาพแสดงกระบวนการกัดกร่อนทางเคมีไฟฟ้า ที่ขั้วหนึ่ง โลหะฐานจะละลาย (กัดกร่อน) และอีกขั้วหนึ่งจะปล่อยไฮโดรเจนออกมา การกัดกร่อนของสารเคมี
เรียกว่าการทำลายโลหะและโลหะผสมในก๊าซแห้งที่อุณหภูมิสูงและในของเหลวที่ไม่มีคุณสมบัติของอิเล็กโทรไลต์ เช่น น้ำมัน น้ำมันเบนซิน เกลือหลอมเหลว เป็นต้น ในระหว่างการกัดกร่อนของสารเคมีภายใต้อิทธิพลของออกซิเจนในชั้นบรรยากาศ โลหะจะถูกปกคลุมด้วยชั้นออกไซด์บาง ๆ ด้วยการกัดกร่อนทางเคมี โลหะไม่ได้ถูกทำลายเพียงพื้นผิวเสมอไป แต่การกัดกร่อนยังแทรกซึมเข้าไปในส่วนลึกของโลหะ ก่อตัวเป็นช่องหรือตั้งอยู่ตามขอบเขตของเกรน (ตัวอย่าง: สิ่งของที่เป็นเงินจะมืดลงเมื่อเวลาผ่านไปเนื่องจากอากาศมีสารประกอบกำมะถันที่เป็นก๊าซซึ่งทำปฏิกิริยาทางเคมีกับเงิน ซิลเวอร์ซัลไฟด์ที่เกิดขึ้นจะยังคงอยู่บนพื้นผิวของสิ่งของในรูปของฟิล์มสีน้ำตาลหรือสีดำ)
มาตรการต่อสู้กับการกัดกร่อนของโลหะ – นี่คือการใช้ชั้นบางๆ ของโลหะอื่นบนโลหะที่มีความต้านทานการกัดกร่อนสูง การเคลือบโลหะมีดังต่อไปนี้: ร้อน กัลวานิก การแพร่กระจาย การทำให้เป็นโลหะ ฯลฯ
ด้วยวิธีการดับร้อนผลิตภัณฑ์ถูกแช่อยู่ในอ่างโลหะหลอมเหลว: สังกะสี (ชุบสังกะสี), ดีบุก (tinning), ตะกั่ว (ชุบตะกั่ว)
วิธีกัลวานิกประกอบด้วยความจริงที่ว่าโลหะบาง ๆ (จาก 0.005 ถึง 0.03 มม.) ถูกนำไปใช้กับพื้นผิวของผลิตภัณฑ์โดยอิเล็กโทรไลซิสของสารละลายเกลือของสังกะสี, ดีบุก, นิกเกิล, โครเมียม ฯลฯ
วิธีการแพร่กระจายประกอบด้วยการดูดซับโดยพื้นผิวของโลหะของโลหะป้องกันที่แทรกซึมเข้าไปที่อุณหภูมิสูง
การทำให้เป็นโลหะ(การฉีดพ่น) - การใช้โลหะหลอมเหลวบาง ๆ กับผลิตภัณฑ์ด้วยปืนพิเศษ - เครื่องเคลือบโลหะไฟฟ้า
การหุ้ม –การเคลือบแผ่นโลหะในระหว่างกระบวนการรีดด้วยชั้นบาง ๆ ของโลหะอื่นที่ทนทานต่อการกัดกร่อนได้ดีกว่า
การเคลือบสารเคมี(ออกซิเดชันหรือฟอสเฟต) ประกอบด้วยการสร้างฟิล์มออกไซด์หนาแน่นบนพื้นผิวโลหะเทียมซึ่งมีความทนทานต่อการกัดกร่อนสูงแล้วตามด้วยการเคลือบด้วยน้ำมันหรือสี
การระบายสี(การเคลือบด้วยสี วาร์นิช และอีนาเมล) เป็นวิธีที่ง่ายและพบได้บ่อยที่สุดในการปกป้องผลิตภัณฑ์จากการกัดกร่อน
การหล่อลื่นปกป้องผลิตภัณฑ์โลหะจากการกัดกร่อน การหล่อลื่นด้วยน้ำมันถูกนำมาใช้กันอย่างแพร่หลายเพื่อปกป้องชิ้นส่วนที่หมุนและเคลื่อนไหวของเครื่องมือกลและเครื่องจักรจากการกัดกร่อน
การป้องกันไฟฟ้าเคมี(รูปที่ 14.) (การป้องกันแคโทด)การป้องกันการกัดกร่อนของโลหะหนึ่งโดยใช้แอโนดป้องกันแบบ "บูชายัญ" ที่ทำจากโลหะอีกชนิดหนึ่ง (ขึ้นอยู่กับตำแหน่งของโลหะในชุดแรงดันไฟฟ้าเคมีไฟฟ้าของโลหะ)
มะเดื่อ 14. วิธีการป้องกันแคโทดต่อการกัดกร่อน: ด้วยแอโนด "บูชายัญ" - ตัวป้องกัน (a); ด้วยขั้วบวกเสริมและแหล่งกระแสภายนอก (b)
เมื่อโลหะทำปฏิกิริยากับสารในสิ่งแวดล้อม สารประกอบจะเกิดขึ้นบนพื้นผิวซึ่งมีคุณสมบัติแตกต่างไปจากตัวโลหะอย่างสิ้นเชิง ในชีวิตประจำวันเรามักจะพูดซ้ำคำว่า “สนิม››“สนิม” โดยเห็นการเคลือบสีน้ำตาลเหลืองบนผลิตภัณฑ์ที่ทำจากเหล็กและโลหะผสม
สนิมเป็นกรณีพิเศษของการกัดกร่อน
การกัดกร่อนเป็นกระบวนการทำลายโลหะโดยธรรมชาติภายใต้อิทธิพลของสภาพแวดล้อมภายนอก
อย่างไรก็ตาม โลหะเกือบทั้งหมดอาจถูกทำลายได้ ซึ่งส่งผลให้คุณสมบัติหลายอย่างเสื่อมลง (หรือสูญเสียไปโดยสิ้นเชิง): ความแข็งแรง ความเหนียว ความมันเงาลดลง ค่าการนำไฟฟ้าลดลง และแรงเสียดทานระหว่างชิ้นส่วนเครื่องจักรที่เคลื่อนไหวเพิ่มขึ้น ขนาดของชิ้นส่วน การเปลี่ยนแปลง ฯลฯ
โดยธรรมชาติทางเคมี การกัดกร่อนเป็นกระบวนการรีดิวซ์ออกซิเดชัน การกัดกร่อนสองประเภทนั้นขึ้นอยู่กับสภาพแวดล้อมที่เกิดขึ้น
ประเภทของการกัดกร่อน
1. การกัดกร่อนของสารเคมี – คือการทำลายของโลหะอันเป็นผลมาจากปฏิกิริยาทางเคมีกับสิ่งแวดล้อม เป็นเรื่องปกติสำหรับสภาพแวดล้อมที่ไม่นำกระแสไฟฟ้า ตามเงื่อนไขของกระบวนการกัดกร่อนมีความโดดเด่นดังต่อไปนี้:
ก)การกัดกร่อนของแก๊ส – ปฏิกิริยาของโลหะที่อุณหภูมิสูงกับตัวกลางก๊าซที่ใช้งานอยู่ O 2, H 2 S, SO 2, ฮาโลเจน ฯลฯ
3เฟ + 2O 2 เฟ 3 โอ 4
4อัล + 3O 2 2อัล 2 โอ 3
โลหะส่วนใหญ่ถูกออกซิไดซ์โดยออกซิเจนในบรรยากาศ ทำให้เกิดฟิล์มออกไซด์บนพื้นผิว หากฟิล์มนี้มีความแข็งแรง หนาแน่น และยึดเกาะกับโลหะได้ดี ก็จะช่วยปกป้องโลหะจากการถูกทำลายเพิ่มเติม ฟิล์มป้องกันดังกล่าวปรากฏใน Zn, AI, Cr, Ni, Sn, Pb, Nb, Ta ฯลฯ ในเหล็กจะหลวม มีรูพรุน แยกออกจากพื้นผิวได้ง่ายจึงไม่สามารถปกป้องโลหะจากการถูกทำลายเพิ่มเติมได้
ข) การกัดกร่อนในสารที่ไม่ใช่อิเล็กโทรไลต์ – ของเหลวอินทรีย์ที่มีฤทธิ์รุนแรง เช่น น้ำมัน ผลิตภัณฑ์ปิโตรเลียม ฯลฯ การกัดกร่อนของสารเคมีค่อนข้างน้อยและมีความเร็วต่ำ
2. การกัดกร่อนด้วยไฟฟ้าเคมี

- นี่คือการทำลายโลหะภายใต้อิทธิพลของสิ่งแวดล้อมอันเป็นผลมาจากการก่อตัวของคู่กัลวานิก ไมโครกัลวานิกคู่หลายแบบเกิดขึ้นเมื่อโลหะชนิดต่างๆ สัมผัสกันในสภาพแวดล้อมของอิเล็กโทรไลต์ใดๆ เมื่อมีสิ่งเจือปนในโลหะ เมื่อโลหะสัมผัสกับสารละลายอิเล็กโทรไลต์ที่มีความเข้มข้นต่างกันที่จุดต่างกันในสารละลาย หรือเมื่อ โลหะมีความเค้นเชิงกลไม่สม่ำเสมอ
ในการกัดกร่อนทางเคมีไฟฟ้า กระบวนการอันตรกิริยาของโลหะกับตัวออกซิไดเซอร์ด้านสิ่งแวดล้อมประกอบด้วยกระบวนการที่สัมพันธ์กันสองกระบวนการ:ก) ออกซิเดชันขั้วบวกของโลหะที่ใช้งานมากขึ้น:
ฉัน 0 – n e - ฉัน n +
b) การลด cathodic ของตัวออกซิไดเซอร์สิ่งแวดล้อม:
ในสภาพแวดล้อมที่เป็นกรด H+ ไอออนจะลดลงบนพื้นผิวแคโทด และไฮโดรเจนจะถูกปล่อยออกมา:
2Н + + 2 อี - Н 2
ในสภาพแวดล้อมที่เป็นกลางและเป็นด่าง ออกซิเจนโมเลกุลจะลดลงบนพื้นผิวแคโทดเพื่อสร้างไอออนไฮดรอกไซด์:
O 2 + 2H 2 O + 4 อี - 4OH -
นอกจากปฏิกิริยาขั้วบวกและแคโทดแล้ว ในระหว่างการกัดกร่อนทางเคมีไฟฟ้า ยังมีการเคลื่อนที่ของอิเล็กตรอนในโลหะจากบริเวณขั้วบวกไปยังขั้วแคโทด และการเคลื่อนที่ของไอออนในอิเล็กโทรไลต์ อิเล็กโทรไลต์สามารถเป็นสารละลายของเกลือ กรดและเบส น้ำทะเล น้ำในดิน น้ำในบรรยากาศที่มี CO 2, SO 2, O 2 และก๊าซอื่นๆ
มีการใช้วิธีการต่างๆ เพื่อปกป้องโลหะจากการกัดกร่อน:
1) การเคลือบป้องกัน (โลหะและอโลหะ)
2) การป้องกันไฟฟ้าเคมี
3) การผสมโลหะ
4) การเปลี่ยนแปลงคุณสมบัติของสภาพแวดล้อมที่มีฤทธิ์กัดกร่อน

เพื่อป้องกันเหล็กจากการกัดกร่อนจึงใช้การเคลือบทุกชนิด: สี, ชั้นของโลหะ (ดีบุก, สังกะสี) ในเวลาเดียวกัน สีและดีบุกจะป้องกันการกัดกร่อนตราบใดที่ชั้นป้องกันยังคงอยู่ การปรากฏตัวของรอยแตกและรอยขีดข่วนช่วยให้ความชื้นและอากาศซึมเข้าสู่พื้นผิวของเหล็กและกระบวนการกัดกร่อนกลับมาดำเนินต่อและในกรณีของการเคลือบดีบุกก็จะเร่งตัวเร็วขึ้นเนื่องจากดีบุกทำหน้าที่เป็นแคโทดในกระบวนการเคมีไฟฟ้า
เหล็กชุบสังกะสีมีพฤติกรรมแตกต่างออกไป เนื่องจากสังกะสีทำหน้าที่เป็นขั้วบวก ฟังก์ชั่นการป้องกันจึงยังคงอยู่แม้ว่าการเคลือบสังกะสีจะเสียหายก็ตาม การป้องกันแบบแคโทดิกถูกนำมาใช้กันอย่างแพร่หลายเพื่อลดการกัดกร่อนของท่อใต้ดินและใต้ทะเล และเหล็กรองรับของสายส่งไฟฟ้าแรงสูง แท่นขุดเจาะน้ำมัน และท่าเทียบเรือ

การนำทาง
- การแก้ปัญหารวมกันตามลักษณะเชิงปริมาณของสาร
- การแก้ปัญหา กฎความคงตัวขององค์ประกอบของสาร การคำนวณโดยใช้แนวคิดเรื่อง "มวลโมลาร์" และ "ปริมาณสารเคมี" ของสาร
การกัดกร่อนของสารเคมีเป็นกระบวนการที่ประกอบด้วยการทำลายโลหะเมื่อมีปฏิกิริยากับสภาพแวดล้อมภายนอกที่รุนแรง กระบวนการกัดกร่อนประเภททางเคมีไม่เกี่ยวข้องกับผลกระทบของกระแสไฟฟ้า ด้วยการกัดกร่อนประเภทนี้จะเกิดปฏิกิริยาออกซิเดชั่นโดยที่วัสดุที่ถูกทำลายจะเป็นตัวลดองค์ประกอบด้านสิ่งแวดล้อมในเวลาเดียวกัน
การจำแนกประเภทของสภาพแวดล้อมที่รุนแรงประกอบด้วยการทำลายโลหะสองประเภท:
- การกัดกร่อนของสารเคมีในของเหลวที่ไม่ใช่อิเล็กโทรไลต์
- การกัดกร่อนของก๊าซเคมี
การกัดกร่อนของแก๊ส
การกัดกร่อนทางเคมีประเภทที่พบบ่อยที่สุด การกัดกร่อนของก๊าซ เป็นกระบวนการกัดกร่อนที่เกิดขึ้นในก๊าซที่อุณหภูมิสูง
ลักษณะเฉพาะของสถานะของโลหะที่อุณหภูมิสูงขึ้นจะถูกกำหนดโดยคุณสมบัติสองประการคือความต้านทานความร้อนและความต้านทานความร้อน การต้านทานความร้อนคือระดับความเสถียรของคุณสมบัติทางกลของโลหะที่อุณหภูมิสูงเป็นพิเศษ ความเสถียรของคุณสมบัติทางกลหมายถึงการรักษาความแข็งแรงในระยะเวลานานและความต้านทานต่อการคืบคลาน ความต้านทานความร้อนคือความต้านทานของโลหะต่อฤทธิ์กัดกร่อนของก๊าซที่อุณหภูมิสูง

อัตราการพัฒนาของการกัดกร่อนของก๊าซถูกกำหนดโดยตัวชี้วัดหลายประการ ได้แก่ :
- อุณหภูมิบรรยากาศ
- ส่วนประกอบที่รวมอยู่ในโลหะหรือโลหะผสม
- พารามิเตอร์ของสภาพแวดล้อมที่มีก๊าซอยู่
- ระยะเวลาในการสัมผัสกับสภาพแวดล้อมของก๊าซ
- คุณสมบัติของผลิตภัณฑ์ที่มีฤทธิ์กัดกร่อน
กระบวนการกัดกร่อนได้รับอิทธิพลมากกว่าจากคุณสมบัติและพารามิเตอร์ของฟิล์มออกไซด์ที่ปรากฏบนพื้นผิวโลหะ การเกิดออกไซด์สามารถแบ่งตามลำดับเวลาได้เป็น 2 ระยะ:
- การดูดซับโมเลกุลออกซิเจนบนพื้นผิวโลหะที่ทำปฏิกิริยากับบรรยากาศ
- การสัมผัสพื้นผิวโลหะกับแก๊สทำให้เกิดสารประกอบเคมี

ระยะแรกมีลักษณะเป็นพันธะไอออนิกซึ่งเป็นผลมาจากปฏิกิริยาระหว่างออกซิเจนและอะตอมบนพื้นผิว เมื่ออะตอมออกซิเจนรับอิเล็กตรอนคู่หนึ่งจากโลหะ พันธะที่เกิดขึ้นมีความแข็งแรงเป็นพิเศษ โดยมีค่ามากกว่าพันธะของออกซิเจนกับโลหะในออกไซด์
คำอธิบายสำหรับความเชื่อมโยงนี้อยู่ที่การกระทำของสนามอะตอมกับออกซิเจน ทันทีที่พื้นผิวโลหะเต็มไปด้วยสารออกซิไดซ์ (และสิ่งนี้เกิดขึ้นเร็วมาก) ที่อุณหภูมิต่ำด้วยแรงแวนเดอร์วาลส์ การดูดซับของโมเลกุลออกซิไดซ์จะเริ่มขึ้น ผลลัพธ์ของปฏิกิริยาคือลักษณะของฟิล์มโมโนโมเลกุลบาง ๆ ซึ่งจะหนาขึ้นเมื่อเวลาผ่านไปทำให้การเข้าถึงออกซิเจนมีความซับซ้อน
ในระยะที่สอง ปฏิกิริยาเคมีจะเกิดขึ้น ในระหว่างที่องค์ประกอบออกซิไดซ์ของตัวกลางดึงเวเลนซ์อิเล็กตรอนจากโลหะ การกัดกร่อนของสารเคมีเป็นผลสุดท้ายของปฏิกิริยา
ลักษณะของฟิล์มออกไซด์
การจำแนกประเภทของฟิล์มออกไซด์มีสามประเภท:
- บาง (มองไม่เห็นโดยไม่มีอุปกรณ์พิเศษ);
- ปานกลาง (สีมัวหมอง);
- หนา (มองเห็นได้ด้วยตาเปล่า)
ฟิล์มออกไซด์ที่ได้นั้นมีความสามารถในการป้องกัน - ช้าลงหรือยับยั้งการกัดกร่อนของสารเคมีได้อย่างสมบูรณ์ นอกจากนี้การมีฟิล์มออกไซด์ยังช่วยเพิ่มความต้านทานความร้อนของโลหะอีกด้วย
อย่างไรก็ตาม ภาพยนตร์ที่มีประสิทธิภาพอย่างแท้จริงจะต้องมีคุณสมบัติหลายประการ:
- ไม่มีรูพรุน
- มีโครงสร้างต่อเนื่องกัน
- มีคุณสมบัติยึดเกาะที่ดี
- ความเฉื่อยทางเคมีแตกต่างกันตามบรรยากาศ
- แข็งและทนทานต่อการสึกหรอ
เงื่อนไขข้อใดข้อหนึ่งข้างต้น - โครงสร้างที่ต่อเนื่อง - เป็นสิ่งสำคัญอย่างยิ่ง สภาวะต่อเนื่องคือปริมาตรของโมเลกุลฟิล์มออกไซด์ที่มากเกินไปเหนือปริมาตรของอะตอมของโลหะ ความต่อเนื่องคือความสามารถของออกไซด์ในการปกคลุมพื้นผิวโลหะทั้งหมดด้วยชั้นที่ต่อเนื่องกัน หากไม่เป็นไปตามเงื่อนไขนี้จะถือว่าฟิล์มไม่สามารถป้องกันได้ อย่างไรก็ตาม มีข้อยกเว้นสำหรับกฎนี้: สำหรับโลหะบางชนิด เช่น แมกนีเซียมและธาตุอัลคาไลน์เอิร์ธ (ยกเว้นเบริลเลียม) ความต่อเนื่องไม่ใช่ตัวบ่งชี้ที่สำคัญ

มีการใช้เทคนิคหลายอย่างเพื่อกำหนดความหนาของฟิล์มออกไซด์ สามารถกำหนดคุณสมบัติการปกป้องของฟิล์มได้ในขณะที่สร้างฟิล์ม เมื่อต้องการทำเช่นนี้ จะมีการศึกษาอัตราการออกซิเดชันของโลหะและพารามิเตอร์ของอัตราการเปลี่ยนแปลงเมื่อเวลาผ่านไป
สำหรับออกไซด์ที่ก่อตัวแล้ว จะใช้วิธีการอื่นซึ่งประกอบด้วยการศึกษาความหนาและลักษณะการป้องกันของฟิล์ม เมื่อต้องการทำเช่นนี้ ให้ใช้รีเอเจนต์กับพื้นผิว จากนั้น ผู้เชี่ยวชาญจะบันทึกเวลาที่ใช้ในการเจาะทะลุของรีเอเจนต์ และจากข้อมูลที่ได้รับ พวกเขาจึงได้ข้อสรุปเกี่ยวกับความหนาของฟิล์ม
ใส่ใจ! แม้แต่ฟิล์มออกไซด์ที่ขึ้นรูปเต็มที่ก็ยังคงมีปฏิกิริยากับสภาพแวดล้อมออกซิไดซ์และโลหะ
อัตราการพัฒนาของการกัดกร่อน
ความรุนแรงของการกัดกร่อนของสารเคมีจะขึ้นอยู่กับระบอบอุณหภูมิ ที่อุณหภูมิสูง กระบวนการออกซิเดชั่นจะพัฒนาเร็วขึ้น นอกจากนี้ การลดบทบาทของปัจจัยทางอุณหพลศาสตร์ในการทำปฏิกิริยาจะไม่ส่งผลกระทบต่อกระบวนการ
การทำความเย็นและการทำความร้อนแบบแปรผันมีความสำคัญมาก เนื่องจากความเครียดจากความร้อน รอยแตกจึงปรากฏในฟิล์มออกไซด์ องค์ประกอบออกซิไดซ์จะไปถึงพื้นผิวผ่านรู เป็นผลให้เกิดชั้นฟิล์มออกไซด์ใหม่และชั้นเก่าลอกออก

ส่วนประกอบของสภาพแวดล้อมที่เป็นก๊าซก็มีบทบาทสำคัญเช่นกัน ปัจจัยนี้เป็นปัจจัยเฉพาะสำหรับโลหะประเภทต่างๆ และสอดคล้องกับความผันผวนของอุณหภูมิ ตัวอย่างเช่น ทองแดงจะกัดกร่อนอย่างรวดเร็วหากสัมผัสกับออกซิเจน แต่สามารถต้านทานกระบวนการนี้ได้ในสภาพแวดล้อมที่มีซัลเฟอร์ออกไซด์ ในทางกลับกัน นิกเกิล ซัลเฟอร์ออกไซด์เป็นอันตรายและมีความคงตัวในออกซิเจน คาร์บอนไดออกไซด์ และสภาพแวดล้อมที่เป็นน้ำ แต่โครเมียมสามารถทนต่อสภาพแวดล้อมที่กล่าวมาทั้งหมดได้
ใส่ใจ! หากระดับความดันการแยกตัวของออกไซด์เกินความดันขององค์ประกอบออกซิไดซ์ กระบวนการออกซิเดชันจะหยุดลงและโลหะจะได้รับความเสถียรทางอุณหพลศาสตร์
อัตราการเกิดปฏิกิริยาออกซิเดชันยังได้รับผลกระทบจากส่วนประกอบของโลหะผสมอีกด้วย ตัวอย่างเช่น แมงกานีส ซัลเฟอร์ นิกเกิล และฟอสฟอรัสไม่มีส่วนช่วยในการออกซิเดชันของเหล็กในทางใดทางหนึ่ง แต่อลูมิเนียม ซิลิคอน และโครเมียมทำให้กระบวนการช้าลง โคบอลต์ ทองแดง เบริลเลียม และไทเทเนียม ชะลอการเกิดออกซิเดชันของเหล็กมากยิ่งขึ้น การเติมวานาเดียม ทังสเตน และโมลิบดีนัมจะช่วยให้กระบวนการรุนแรงขึ้น ซึ่งอธิบายได้จากความสามารถในการหลอมและความผันผวนของโลหะเหล่านี้ ปฏิกิริยาออกซิเดชันจะเกิดขึ้นช้าที่สุดกับโครงสร้างออสเทนนิติก เนื่องจากจะปรับให้เข้ากับอุณหภูมิสูงได้มากที่สุด

อีกปัจจัยหนึ่งที่ขึ้นอยู่กับอัตราการกัดกร่อนคือลักษณะของพื้นผิวที่ผ่านการบำบัด พื้นผิวเรียบออกซิไดซ์ได้ช้ากว่า และพื้นผิวที่ไม่เรียบออกซิไดซ์เร็วขึ้น
การกัดกร่อนในของเหลวที่ไม่ใช่อิเล็กโทรไลต์
ตัวกลางของเหลวที่ไม่นำไฟฟ้า (เช่น ของเหลวที่ไม่เป็นอิเล็กโทรไลต์) รวมถึงสารอินทรีย์ เช่น:
- เบนซิน;
- คลอโรฟอร์ม;
- แอลกอฮอล์;
- คาร์บอนเตตระคลอไรด์
- ฟีนอล;
- น้ำมัน;
- น้ำมันเบนซิน;
- น้ำมันก๊าด ฯลฯ

นอกจากนี้ ของเหลวอนินทรีย์จำนวนเล็กน้อย เช่น โบรมีนเหลวและกำมะถันหลอมเหลว ถือเป็นของเหลวที่ไม่ใช่อิเล็กโทรไลต์
ควรสังเกตว่าตัวทำละลายอินทรีย์เองไม่ทำปฏิกิริยากับโลหะอย่างไรก็ตามเมื่อมีสิ่งสกปรกในปริมาณเล็กน้อยกระบวนการโต้ตอบที่เข้มข้นจะเกิดขึ้น
องค์ประกอบที่มีซัลเฟอร์ในน้ำมันจะเพิ่มอัตราการกัดกร่อน นอกจากนี้อุณหภูมิสูงและการมีออกซิเจนในของเหลวยังทำให้กระบวนการกัดกร่อนรุนแรงขึ้น ความชื้นจะทำให้การกัดกร่อนรุนแรงขึ้นตามหลักการระบบเครื่องกลไฟฟ้า
ปัจจัยอีกประการหนึ่งที่ทำให้เกิดการกัดกร่อนอย่างรวดเร็วคือโบรมีนเหลว ที่อุณหภูมิปกติจะเป็นอันตรายต่อเหล็กกล้าคาร์บอนสูง อลูมิเนียม และไทเทเนียมโดยเฉพาะ ผลกระทบของโบรมีนต่อเหล็กและนิกเกิลมีนัยสำคัญน้อยกว่า ตะกั่ว เงิน แทนทาลัม และแพลทินัมมีความต้านทานต่อโบรมีนเหลวมากที่สุด

กำมะถันหลอมเหลวทำปฏิกิริยารุนแรงกับโลหะเกือบทั้งหมด โดยหลักๆ คือตะกั่ว ดีบุก และทองแดง ซัลเฟอร์มีผลน้อยต่อเหล็กกล้าคาร์บอนและไทเทเนียม และทำลายอะลูมิเนียมได้เกือบทั้งหมด
มาตรการป้องกันสำหรับโครงสร้างโลหะที่อยู่ในสภาพแวดล้อมของเหลวที่ไม่นำไฟฟ้านั้นดำเนินการโดยการเพิ่มโลหะที่ทนทานต่อสภาพแวดล้อมเฉพาะ (เช่นเหล็กที่มีปริมาณโครเมียมสูง)
นอกจากนี้ยังใช้การเคลือบป้องกันพิเศษ (เช่นในสภาพแวดล้อมที่มีกำมะถันจำนวนมากจะใช้การเคลือบอลูมิเนียม)
วิธีการป้องกันการกัดกร่อน

วิธีการควบคุมการกัดกร่อนได้แก่:
การเลือกใช้วัสดุเฉพาะขึ้นอยู่กับประสิทธิภาพที่เป็นไปได้ (รวมถึงเทคโนโลยีและการเงิน) ในการใช้งาน
- หลักการสมัยใหม่ของการปกป้องโลหะนั้นใช้เทคนิคดังต่อไปนี้:
- การปรับปรุงความทนทานต่อสารเคมีของวัสดุ วัสดุที่ทนต่อสารเคมี (พลาสติกโพลีเมอร์สูง แก้ว เซรามิค) ได้พิสูจน์ตัวเองแล้ว
- การแยกวัสดุออกจากสภาพแวดล้อมที่รุนแรง
- ลดความก้าวร้าวของสภาพแวดล้อมทางเทคโนโลยี ตัวอย่างของการกระทำดังกล่าว ได้แก่ การทำให้เป็นกลางและการกำจัดความเป็นกรดในสภาพแวดล้อมที่มีฤทธิ์กัดกร่อน รวมถึงการใช้สารยับยั้งต่างๆ
การป้องกันไฟฟ้าเคมี (การใช้งานกระแสไฟภายนอก)
- วิธีการข้างต้นแบ่งออกเป็นสองกลุ่ม:
- มีการใช้การเสริมความทนทานต่อสารเคมีและฉนวนก่อนเริ่มใช้งานโครงสร้างเหล็ก
การลดความก้าวร้าวของสิ่งแวดล้อมและการป้องกันไฟฟ้าเคมีถูกนำมาใช้แล้วในกระบวนการใช้ผลิตภัณฑ์โลหะ การใช้เทคนิคทั้งสองนี้ทำให้สามารถแนะนำวิธีการป้องกันแบบใหม่ได้ซึ่งเป็นผลมาจากการป้องกันที่ได้รับจากการเปลี่ยนแปลงสภาพการทำงาน

หนึ่งในวิธีการปกป้องโลหะที่ใช้กันมากที่สุด - การเคลือบป้องกันการกัดกร่อนด้วยไฟฟ้า - ไม่สามารถทำกำไรได้ในเชิงเศรษฐกิจสำหรับพื้นที่ผิวขนาดใหญ่
- เหตุผลก็คือต้นทุนสูงของกระบวนการเตรียมการ
- สถานที่ชั้นนำในวิธีการป้องกันนั้นถูกครอบครองโดยการเคลือบโลหะด้วยสีและสารเคลือบเงา ความนิยมของวิธีการต่อสู้กับการกัดกร่อนนี้เกิดจากปัจจัยหลายประการรวมกัน:
- คุณสมบัติการป้องกันสูง (การไม่ชอบน้ำ, แรงผลักของของเหลว, การซึมผ่านของก๊าซและไอต่ำ)
- ความสามารถในการผลิต;
- โอกาสที่เพียงพอสำหรับการแก้ปัญหาการตกแต่ง
การบำรุงรักษา;
- เหตุผลทางเศรษฐกิจ
- ในขณะเดียวกัน การใช้วัสดุที่มีอยู่อย่างแพร่หลายก็ไม่ได้มีข้อเสีย:
- พื้นผิวโลหะเปียกไม่สมบูรณ์
อย่างไรก็ตาม พื้นผิวที่ทาสียังช่วยปกป้องโลหะจากกระบวนการกัดกร่อน แม้ว่าจะมีความเสียหายเป็นชิ้นเป็นอันกับฟิล์ม ในขณะที่การเคลือบกัลวานิกที่ไม่สมบูรณ์ยังสามารถเร่งการกัดกร่อนได้อีกด้วย
สารเคลือบออร์กาโนซิลิเกต

การกัดกร่อนของสารเคมีใช้ไม่ได้กับวัสดุออร์กาโนซิลิเกต เหตุผลอยู่ที่ความเสถียรทางเคมีที่เพิ่มขึ้นขององค์ประกอบดังกล่าว ความต้านทานต่อแสง คุณสมบัติที่ไม่ชอบน้ำ และการดูดซึมน้ำต่ำ ออร์กาโนซิลิเกตยังทนทานต่ออุณหภูมิต่ำ มีคุณสมบัติยึดเกาะที่ดีและทนต่อการสึกหรอ
ปัญหาการทำลายโลหะเนื่องจากการกัดกร่อนจะไม่หายไปแม้ว่าจะมีการพัฒนาเทคโนโลยีเพื่อต่อสู้กับปัญหาเหล่านี้ก็ตาม เหตุผลก็คือปริมาณการผลิตโลหะที่เพิ่มขึ้นอย่างต่อเนื่องและสภาวะการปฏิบัติงานที่ยากลำบากมากขึ้นสำหรับผลิตภัณฑ์ที่ผลิตจากโลหะเหล่านี้ ในขั้นตอนนี้เป็นไปไม่ได้ที่จะแก้ไขปัญหาได้อย่างสมบูรณ์ ดังนั้นความพยายามของนักวิทยาศาสตร์จึงมุ่งเน้นไปที่การค้นหาวิธีชะลอกระบวนการกัดกร่อน
การกัดกร่อนมักเรียกว่าการทำลายโลหะโดยธรรมชาติอันเป็นผลมาจากปฏิกิริยาทางเคมีและไฟฟ้าเคมีกับสภาพแวดล้อมภายนอกและการเปลี่ยนสภาพเป็นสารประกอบที่เสถียร (ออกไซด์, ไฮดรอกไซด์, เกลือ)
พูดอย่างเคร่งครัด การกัดกร่อนคือชุดของกระบวนการรีดอกซ์ที่เกิดขึ้นเมื่อโลหะสัมผัสกับสภาพแวดล้อมที่รุนแรง ซึ่งนำไปสู่การทำลายผลิตภัณฑ์โลหะ ในสภาพแวดล้อมที่รุนแรง เราหมายถึงบรรยากาศออกไซด์ (การมีออกซิเจนในชั้นบรรยากาศโลกทำให้เกิดออกไซด์) โดยเฉพาะอย่างยิ่งเมื่อมีน้ำหรือสารละลายอิเล็กโทรไลต์
ขึ้นอยู่กับกลไกของกระบวนการ ทำให้เกิดความแตกต่างระหว่างการกัดกร่อนทางเคมีและเคมีไฟฟ้าของโลหะ การกัดกร่อนของสารเคมีเป็นปฏิกิริยาทางเคมีทั่วไประหว่างอะตอมของโลหะกับสารออกซิไดซ์ต่างๆ ตัวอย่างของการกัดกร่อนทางเคมี ได้แก่ ออกซิเดชันที่อุณหภูมิสูงของโลหะกับออกซิเจน ออกซิเดชันของพื้นผิวอะลูมิเนียมในอากาศ ปฏิกิริยาของโลหะกับคลอรีน ซัลเฟอร์ ไฮโดรเจนซัลไฟด์เอช 2 ส ฯลฯ
การกัดกร่อนทางเคมีไฟฟ้าเกิดขึ้นในสารละลาย ซึ่งโดยหลักแล้วเมื่อโลหะสัมผัสกับสารละลายอิเล็กโทรไลต์ โดยเฉพาะอย่างยิ่งในกรณีที่โลหะสัมผัสกับโลหะที่มีความว่องไวน้อย อัตราการกัดกร่อนขึ้นอยู่กับกิจกรรมของโลหะอย่างมีนัยสำคัญ ตลอดจนความเข้มข้นและธรรมชาติของสิ่งเจือปนในน้ำ ในน้ำบริสุทธิ์ โลหะแทบจะไม่สึกกร่อน และเมื่อสัมผัสกับโลหะที่มีฤทธิ์มากกว่า แม้แต่ในสารละลายอิเล็กโทรไลต์ ก็จะไม่กัดกร่อน
โลหะหลายชนิด รวมทั้งเหล็ก พบได้ในเปลือกโลกในรูปของออกไซด์ การเปลี่ยนจากโลหะเป็นออกไซด์เป็นกระบวนการที่มีพลัง กล่าวอีกนัยหนึ่งคือ ออกไซด์เป็นสารประกอบที่เสถียรมากกว่าโลหะ เพื่อที่จะย้อนกลับกระบวนการและแยกโลหะออกจากแร่ จำเป็นต้องใช้พลังงานจำนวนมาก ดังนั้นเหล็กจึงมีแนวโน้มที่จะเปลี่ยนกลับเป็นออกไซด์ - อย่างที่พวกเขาพูดกันว่าเป็นสนิมเหล็ก การเกิดสนิมเป็นคำที่ใช้เรียกการกัดกร่อน ซึ่งเป็นกระบวนการออกซิเดชันของโลหะภายใต้อิทธิพลของสิ่งแวดล้อม
วัฏจักรของโลหะในธรรมชาติสามารถอธิบายได้โดยใช้แผนภาพต่อไปนี้:
ผลิตภัณฑ์โลหะเกิดสนิมเนื่องจากเหล็กที่ใช้ทำปฏิกิริยากับออกซิเจนและน้ำที่มีอยู่ในบรรยากาศ ในระหว่างการกัดกร่อนของเหล็กหรือเหล็กกล้า จะเกิดรูปแบบไฮเดรตของเฟอร์รัม (III) ออกไซด์ขององค์ประกอบต่างๆ(เฟ 2 โอ 3 ∙ xH 2 โอ) ออกไซด์สามารถซึมผ่านอากาศและน้ำได้และไม่ก่อให้เกิดชั้นป้องกันบนพื้นผิวโลหะ ดังนั้นการกัดกร่อนของโลหะยังคงดำเนินต่อไปภายใต้ชั้นของสนิมที่ก่อตัวขึ้น
เมื่อโลหะสัมผัสกับอากาศชื้น โลหะเหล่านั้นมักจะถูกกัดกร่อนอยู่เสมอ แต่มีหลายปัจจัยที่ส่งผลต่ออัตราการเกิดสนิม ในหมู่พวกเขามีดังต่อไปนี้: การปรากฏตัวของสิ่งสกปรกในโลหะ; การมีกรดหรืออิเล็กโทรไลต์อื่น ๆ ในสารละลายที่สัมผัสกับพื้นผิวของเหล็ก ออกซิเจนที่มีอยู่ในสารละลายเหล่านี้
กลไกการกัดกร่อนทางเคมีไฟฟ้าของพื้นผิวโลหะ
ในกรณีส่วนใหญ่ การกัดกร่อนเป็นกระบวนการไฟฟ้าเคมี เซลล์ไฟฟ้าเคมีถูกสร้างขึ้นบนพื้นผิวของโลหะ โดยพื้นที่ต่างๆ ทำหน้าที่เป็นพื้นที่ออกซิเดชันและพื้นที่รีดิวซ์
ด้านล่างนี้เป็นปฏิกิริยาสองประการของกระบวนการเกิดสนิมรีดอกซ์:

สมการโดยรวมสำหรับปฏิกิริยาการกัดกร่อนของเหล็กสามารถเขียนได้ดังนี้:
ในทางแผนผัง กระบวนการที่เกิดขึ้นบนพื้นผิวเหล็กหรือเหล็กกล้าเมื่อสัมผัสกับน้ำสามารถแสดงได้ดังนี้:

ความเข้มข้นของออกซิเจนที่ละลายในหยดน้ำจะเป็นตัวกำหนดว่าบริเวณใดบนพื้นผิวโลหะคือบริเวณที่เกิดปฏิกิริยารีดักชัน และบริเวณใดคือบริเวณที่เกิดออกซิเดชัน
ที่ขอบของหยดซึ่งมีความเข้มข้นของออกซิเจนละลายน้ำสูงกว่า ออกซิเจนจะลดลงเป็นไอออนไฮดรอกไซด์
อิเล็กตรอนจำเป็นต้องลดออกซิเจนให้เคลื่อนที่จากจุดศูนย์กลางของหยด ซึ่งจะถูกปล่อยออกมาในระหว่างการออกซิเดชันของเหล็ก และในกรณีที่ความเข้มข้นของออกซิเจนที่ละลายในน้ำต่ำ ไอออนของเหล็กจะเข้าสู่สารละลาย อิเล็กตรอนที่ปล่อยออกมาจะเคลื่อนที่ไปตามพื้นผิวโลหะจนถึงขอบของหยด
ข้อมูลข้างต้นอธิบายว่าทำไมการกัดกร่อนจึงรุนแรงที่สุดในบริเวณใจกลางหยดน้ำหรือใต้ชั้นสี ซึ่งเป็นบริเวณที่ปริมาณออกซิเจนมีจำกัด ที่นี่เรียกว่า "เปลือกหอย" เกิดขึ้น โดยที่เหล็กจะเข้าสู่สารละลาย
สนิมเกิดขึ้นจากลำดับของกระบวนการทุติยภูมิในสารละลาย ซึ่งไอออนของเหล็กและไฮดรอกไซด์ไอออนจะกระจายออกจากพื้นผิวโลหะ ไม่มีชั้นป้องกันเกิดขึ้นบนพื้นผิว
กิจกรรมของปฏิกิริยาการลดออกซิเจนขึ้นอยู่กับความเป็นกรดของสภาพแวดล้อม ดังนั้นการกัดกร่อนจึงเร่งตัวเร็วขึ้นในสภาพแวดล้อมที่เป็นกรด สิ่งเจือปนของเกลือใดๆ เช่น โซเดียมคลอไรด์ในสเปรย์น้ำทะเล มีส่วนทำให้เกิดสนิมเนื่องจากสิ่งเหล่านี้จะเพิ่มค่าการนำไฟฟ้าของน้ำ
ปัญหาการกัดกร่อนอาจไม่ได้รับการแก้ไขอย่างสมบูรณ์ และสิ่งที่ดีที่สุดที่คาดหวังได้คือการชะลอความเร็วลง ไม่ใช่หยุดมัน
ปัจจุบันมีหลายวิธีในการป้องกันการกัดกร่อน
การแยกโลหะออกจากสภาพแวดล้อมที่รุนแรง - การทาสี การหล่อลื่นด้วยน้ำมัน การเคลือบด้วยโลหะที่ไม่ใช้งานหรือเคลือบฟัน (I) การนำพื้นผิวของโลหะสัมผัสกับโลหะที่มีความว่องไวมากขึ้น (II) การใช้สารยับยั้งการกัดกร่อน (สารยับยั้งการกัดกร่อน) และโลหะผสมที่ทนต่อการกัดกร่อน (III)
I. วิธีที่ง่ายที่สุดในการปกป้องเหล็กจากการกัดกร่อนคือการแยกโลหะออกจากอากาศในชั้นบรรยากาศ ซึ่งสามารถทำได้โดยใช้น้ำมัน จาระบี หรือใช้ชั้นป้องกันสี
ปัจจุบันมีการใช้สารเคลือบป้องกันที่ทำจากโพลีเมอร์อินทรีย์กันอย่างแพร่หลาย การเคลือบสามารถทำได้ในสีที่ต่างกันและเป็นวิธีแก้ปัญหาการกัดกร่อนที่ค่อนข้างยืดหยุ่น แม้แต่การมองดูสิ่งต่าง ๆ รอบตัวเราในชีวิตประจำวันอย่างรวดเร็วก็ยังมีตัวอย่างมากมายของวิธีแก้ปัญหาดังกล่าว เช่น ตู้เย็น เครื่องอบจาน ถาด จักรยาน ฯลฯ
ครั้งที่สอง บางครั้งเหล็กก็ถูกเคลือบด้วยโลหะอื่นบาง ๆ ผู้ผลิตบางรายสร้างตัวถังรถยนต์จากเหล็กเคลือบสังกะสีเคลือบสังกะสี ด้วยการบำบัดนี้ ชั้นของซิงค์ออกไซด์จะเกาะติดกับฐานอย่างแน่นหนา และหากการเคลือบกัลวานิกไม่เสียหาย ก็จะปกป้องจากเซอร์วิสเบอร์รี่ได้ดี
แม้ว่าการเคลือบดังกล่าวจะมีข้อบกพร่อง แต่ตัวเหล็กของเครื่องยังคงได้รับการปกป้องจากการถูกทำลายอย่างรวดเร็ว เนื่องจากในระบบนี้สังกะสีจะกัดกร่อนมากกว่าเหล็ก เนื่องจากสังกะสีเป็นโลหะที่เกิดปฏิกิริยามากกว่าเหล็ก ในกรณีนี้จะมีการสังเวยสังกะสี หนึ่งในข้อเสนอแรกสุดสำหรับการใช้โลหะบูชายัญ ("บูชายัญ") ถูกสร้างขึ้นในปี พ.ศ. 2367 เพื่อปกป้องการชุบโลหะของตัวเรือเดินทะเลจากการกัดกร่อน
ปัจจุบัน บล็อกสังกะสีถูกนำมาใช้เพื่อปกป้องแท่นขุดเจาะน้ำมันนอกชายฝั่งจากการกัดกร่อน การกัดกร่อนจากโครงสร้างเหล็กที่มีราคาแพงและซับซ้อนจะถูกถ่ายโอนไปยังชิ้นส่วนโลหะที่ง่ายต่อการเปลี่ยน หลักการคุ้มครองดังกล่าวคืออะไร? เรามาอธิบายโดยใช้แผนภาพกัน

ในช่วงเวลาหนึ่งตามแนวรองรับทั้งหมดที่อยู่ในทะเลจะมีการติดบล็อกสังกะสี เนื่องจากสังกะสีมีฤทธิ์มากกว่าเหล็ก (อยู่ทางด้านซ้ายในชุดแรงดันไฟฟ้าเคมีไฟฟ้า) สังกะสีจึงถูกออกซิไดซ์เป็นส่วนใหญ่ และพื้นผิวเหล็กส่วนใหญ่ยังคงไม่ถูกแตะต้อง ตามหลักการแล้ว โลหะใดๆ ก็ตามที่อยู่ทางด้านซ้ายของเหล็กในชุดแรงดันไฟฟ้าเคมีไฟฟ้าสามารถนำมาใช้ในการปกป้องผลิตภัณฑ์เหล็กได้
หลักการที่คล้ายกันนี้ใช้เพื่อปกป้องโครงสร้างคอนกรีตเสริมเหล็กของอาคารที่พักอาศัย โดยแท่งเหล็กทั้งหมดเชื่อมต่อกันและเชื่อมต่อกับชิ้นส่วนของแมกนีเซียมที่ฝังอยู่ในพื้นดิน
III. วิธีแก้ปัญหาทั่วไปในการป้องกันการกัดกร่อนคือการใช้โลหะผสมที่ทนต่อการกัดกร่อน ผลิตภัณฑ์เหล็กหลายชนิดที่ใช้ในชีวิตประจำวันโดยเฉพาะที่ต้องสัมผัสกับน้ำอยู่ตลอดเวลา เช่น อุปกรณ์ในครัว ช้อน ส้อม มีด อ่างเครื่องซักผ้า เป็นต้น - ทำจากสแตนเลสซึ่งไม่ต้องการการปกป้องเพิ่มเติม
เหล็กแข็งถูกประดิษฐ์ขึ้นในปี 1913 โดยนักเคมีของเชฟฟิลด์ แฮร์รี เบรียร์ลีย์ เขาตรวจสอบการสึกหรออย่างรวดเร็วของกระบอกปืนและตัดสินใจลองใช้เหล็กที่มีโครเมียมสูงเพื่อดูว่าจะสามารถยืดอายุของอาวุธด้วยวิธีนี้ได้หรือไม่
โดยทั่วไป เมื่อวิเคราะห์เหล็ก ตัวอย่างจะถูกละลายในกรด เบรียร์ลีย์ซึ่งทำการวิเคราะห์ดังกล่าวประสบปัญหาที่ไม่คาดคิด เหล็กของเขาซึ่งมีโครเมียมสูงไม่ละลาย นอกจากนี้เขายังสังเกตเห็นว่าตัวอย่างที่เหลืออยู่ในห้องปฏิบัติการยังคงความแวววาวดังเดิมไว้ เบรียร์ลีย์ตระหนักได้ทันทีว่าเขาได้ประดิษฐ์เหล็กที่ทนทานต่อการกัดกร่อน
การประดิษฐ์ของ Harry Briarley เผชิญกับอคติบางประการ ผู้ผลิตเครื่องใช้โลหะชั้นนำแห่งหนึ่งของเชฟฟิลด์คิดว่าแนวคิดของไบรอาร์ลีย์ "ขัดต่อธรรมชาติ" และอีกคนหนึ่งกล่าวว่า "การต้านทานต่อการกัดกร่อนไม่ใช่ข้อได้เปรียบอย่างมากสำหรับมีดที่ต้องทำความสะอาดหลังการใช้งานแต่ละครั้ง" ปัจจุบันเราถือว่าเครื่องครัวยังคงความเงางามและไม่ได้รับผลกระทบจากกรดที่มีอยู่ในอาหาร
สแตนเลส เหล็กไม่เป็นสนิมเนื่องจากมีแผ่นฟิล์มโครเมียม (III) ออกไซด์เกิดขึ้นบนพื้นผิว ออกไซด์นี้ต่างจากสนิมตรงที่ไม่ได้รับผลกระทบจากน้ำ และเกาะติดกับพื้นผิวโลหะอย่างแน่นหนา ด้วยความหนาเพียงไม่กี่นาโนเมตร ฟิล์มออกไซด์จึงมองไม่เห็นด้วยตาเปล่า และไม่ได้บดบังความแวววาวตามธรรมชาติของโลหะ ในขณะเดียวกันก็ไม่สามารถเจาะอากาศและน้ำได้และปกป้องโลหะ นอกจากนี้หากขูดฟิล์มพื้นผิวออกก็จะฟื้นตัวอย่างรวดเร็ว
น่าเสียดายที่สแตนเลสมีราคาแพง และเราต้องคำนึงถึงเรื่องนี้เมื่อเลือกเหล็กที่จะใช้ ในเทคโนโลยีสมัยใหม่ เหล็กที่มีความทนทานสูงมักถูกใช้โดยมีองค์ประกอบดังต่อไปนี้: เหล็ก 74%, โครเมียม 18%, นิกเกิล 8%
เนื่องจากการใช้สแตนเลสไม่ได้มีความสมเหตุสมผลในเชิงเศรษฐกิจเสมอไป เช่นเดียวกับการใช้ชั้นป้องกันของสารหล่อลื่นและสี ในปัจจุบันนี้บ่อยครั้งที่พวกเขาใช้สังกะสีบางๆ (เหล็กชุบสังกะสี) หรือดีบุก (เหล็กกระป๋อง) เพื่อเคลือบผลิตภัณฑ์เหล็ก หลังนี้มักใช้ในการผลิตอาหารกระป๋อง
Peter Durand ชาวอังกฤษเป็นผู้เสนอวิธีการปกป้องอาหารกระป๋องโดยการเคลือบพื้นผิวโลหะด้านในด้วยดีบุก ด้วยการป้องกันดังกล่าว อาหารกระป๋องจึงสามารถรับประทานได้เป็นเวลานาน น่าเสียดายที่อุตสาหกรรมอาหารและเครื่องดื่มบรรจุกระป๋องไม่ได้ปราศจากความท้าทาย ผลิตภัณฑ์ที่แตกต่างกันสร้างสภาพแวดล้อมภายในกระป๋องที่แตกต่างกัน ซึ่งส่งผลต่อโลหะที่แตกต่างกันและอาจก่อให้เกิดการกัดกร่อนได้
ในตอนต้นของศตวรรษที่ 20 เริ่มมีการผลิตเบียร์กระป๋อง อย่างไรก็ตาม ผลิตภัณฑ์ใหม่ไม่ประสบความสำเร็จในทันที และเหตุผลก็คือธนาคารถูกทำลายจากภายใน ดีบุกบางๆ ที่ใช้ปิดขวดโหลแทบจะไม่ออกมาแข็งเลย ส่วนใหญ่มักจะมีข้อบกพร่องเล็กน้อย ในสารละลายที่เป็นน้ำ เหล็กจะออกซิไดซ์เร็วกว่าดีบุก (เนื่องจากมีฤทธิ์สูงกว่า) ไอออนของเหล็กเฟ 2+ ละลายในเบียร์ (ซึ่งโดยทั่วไปเป็นวิธีการรักษาที่ดีสำหรับโรคโลหิตจาง) และทำให้เครื่องดื่มมีรสชาติเป็นโลหะและยังลดความโปร่งใสอีกด้วย ทำให้ความนิยมเบียร์กระป๋องลดลง อย่างไรก็ตาม ผู้ผลิตสามารถเอาชนะปัญหานี้ได้หลังจากที่พวกเขาเริ่มเคลือบด้านในของกระป๋องด้วยสารเคลือบเงาออร์แกนิกชนิดเฉื่อยพิเศษ
ผลไม้กระป๋องมีกรดอินทรีย์ เช่น กรดซิตริก ในสารละลาย กรดเหล่านี้ส่งเสริมการจับตัวของไอออนดีบุกเอสเอ็น 2+ และทำให้อัตราการละลายของสารเคลือบดีบุกเพิ่มขึ้น ดังนั้นในผลไม้กระป๋อง (ลูกพีช ฯลฯ) ดีบุกจึงเกิดการกัดกร่อนเป็นหลัก ไอออนของดีบุกที่เข้าไปในอาหารในลักษณะนี้ไม่เป็นพิษ พวกเขาไม่ได้เปลี่ยนรสชาติของผลไม้กระป๋องอย่างมีนัยสำคัญยกเว้นว่าพวกเขาให้รสชาติที่ค้างอยู่ในคอ อย่างไรก็ตามหากเก็บขวดไว้นานเกินไปอาจเกิดปัญหาได้ ชั้นบางๆ ของดีบุกซึ่งถูกออกซิไดซ์จะพังทลายลงในที่สุดภายใต้อิทธิพลของกรดอินทรีย์ และเริ่มกัดกร่อนชั้นเหล็กอย่างรวดเร็ว
คำนิยาม
เมื่อสัมผัสกับสิ่งแวดล้อม โลหะหลายชนิดรวมถึงโลหะผสมที่เป็นโลหะอาจถูกทำลายได้เนื่องจากปฏิกิริยาทางเคมี (ORR กับสารในสิ่งแวดล้อม) กระบวนการนี้เรียกว่า การกัดกร่อน.
ความแตกต่างเกิดขึ้นระหว่างการกัดกร่อนในก๊าซ (การกัดกร่อนของก๊าซ) ซึ่งเกิดขึ้นที่อุณหภูมิสูงโดยไม่มีความชื้นบนพื้นผิวโลหะ และการกัดกร่อนทางเคมีไฟฟ้า (การกัดกร่อนในสารละลายอิเล็กโทรไลต์ เช่นเดียวกับการกัดกร่อนในบรรยากาศชื้น) อันเป็นผลมาจากการกัดกร่อนของแก๊ส ออกไซด์ ซัลไฟด์ ฯลฯ จะเกิดขึ้นบนพื้นผิวของโลหะ ภาพยนตร์ ส่วนควบของเตาหลอม ชิ้นส่วนของเครื่องยนต์สันดาปภายใน ฯลฯ อาจเกิดการกัดกร่อนประเภทนี้ได้
ผลจากการกัดกร่อนทางเคมีไฟฟ้า การเกิดออกซิเดชันของโลหะอาจทำให้เกิดทั้งการก่อตัวของผลิตภัณฑ์ที่ไม่ละลายน้ำและการเปลี่ยนโลหะเป็นสารละลายในรูปของไอออน การกัดกร่อนประเภทนี้ส่งผลต่อท่อที่อยู่ใต้ดิน ชิ้นส่วนใต้น้ำของเรือ เป็นต้น
สารละลายอิเล็กโทรไลต์ใดๆ ก็ตามที่เป็นสารละลายที่เป็นน้ำ และน้ำประกอบด้วยออกซิเจนและไฮโดรเจนที่สามารถลดได้:
O 2 + 4H + +4e = 2H 2 O (1)
2H + +2e=H 2 (2)
องค์ประกอบเหล่านี้เป็นตัวออกซิไดซ์ที่ทำให้เกิดการกัดกร่อนทางเคมีไฟฟ้า
เมื่อเขียนกระบวนการที่เกิดขึ้นระหว่างการกัดกร่อนทางเคมีไฟฟ้า สิ่งสำคัญคือต้องคำนึงถึงศักย์ไฟฟ้ามาตรฐาน (EP) ด้วย ดังนั้น ในสภาพแวดล้อมที่เป็นกลาง EC ของกระบวนการ 1 เท่ากับ 0.8B ดังนั้น โลหะที่มี EC น้อยกว่า 0.8B (โลหะที่อยู่ในลำดับกิจกรรมตั้งแต่เริ่มต้นจนถึงธาตุเงิน) จึงอาจเกิดปฏิกิริยาออกซิเดชันโดยออกซิเจน
EP ของกระบวนการ 2 คือ -0.41V ซึ่งหมายความว่าเฉพาะโลหะที่มีศักยภาพต่ำกว่า -0.41V (โลหะที่อยู่ในชุดกิจกรรมตั้งแต่เริ่มต้นจนถึงแคดเมียม) เท่านั้นที่จะเกิดปฏิกิริยาออกซิเดชันกับไฮโดรเจน
อัตราการกัดกร่อนได้รับอิทธิพลอย่างมากจากสิ่งเจือปนที่โลหะบางชนิดอาจมีอยู่ ดังนั้น หากโลหะมีสิ่งเจือปนที่ไม่ใช่โลหะ และ EC สูงกว่า EC ของโลหะ อัตราการกัดกร่อนก็จะเพิ่มขึ้นอย่างมาก
ประเภทของการกัดกร่อน
การกัดกร่อนมีหลายประเภท: บรรยากาศ (การกัดกร่อนในอากาศชื้นที่ระดับความสูงต่ำ) การกัดกร่อนในดิน การกัดกร่อนที่มีการเติมอากาศไม่สม่ำเสมอ (การเข้าถึงออกซิเจนไปยังส่วนต่างๆ ของผลิตภัณฑ์โลหะในสารละลายไม่เหมือนกัน) การกัดกร่อนจากการสัมผัส (การสัมผัสของ โลหะ 2 ชนิดที่มี EP ต่างกันในสภาพแวดล้อมที่มีความชื้น)
ในระหว่างการกัดกร่อน ปฏิกิริยาไฟฟ้าเคมีจะเกิดขึ้นบนอิเล็กโทรด (แอโนดและแคโทด) ซึ่งสามารถเขียนได้ด้วยสมการที่เกี่ยวข้อง ดังนั้นในสภาพแวดล้อมที่เป็นกรด การกัดกร่อนทางเคมีไฟฟ้าจึงเกิดขึ้นเมื่อมีการดีโพลาไรเซชันของไฮโดรเจน เช่น ไฮโดรเจนถูกปล่อยออกมาที่แคโทด (1) ในสภาพแวดล้อมที่เป็นกลาง การกัดกร่อนทางเคมีไฟฟ้าเกิดขึ้นพร้อมกับการเปลี่ยนขั้วของออกซิเจน โดยน้ำจะลดลงที่แคโทด (2)
K (แคโทด) (+): 2H + +2e=H 2 - การลดลง (1)
A (ขั้วบวก) (-): ฉัน – ne → ฉัน n + – ออกซิเดชัน
K (แคโทด) (+): O 2 + 2H 2 O + 4e → 4OH - - การลดลง (2)
ในกรณีของการกัดกร่อนในบรรยากาศ ปฏิกิริยาเคมีไฟฟ้าต่อไปนี้จะเกิดขึ้นบนอิเล็กโทรด (และที่แคโทด กระบวนการต่างๆ สามารถเกิดขึ้นได้ ขึ้นอยู่กับสภาพแวดล้อม):
A (ขั้วบวก) (-): ฉัน→ฉัน n + +ne
K (แคโทด) (+): O 2 + 2H 2 O + 4e → 4OH - (ในสภาพแวดล้อมที่เป็นด่างและเป็นกลาง)
K (แคโทด) (+): O 2 + 4H + + 4e → 2H 2 O (ในตัวกลางที่เป็นกรด)
ป้องกันการกัดกร่อน
เพื่อป้องกันการกัดกร่อนใช้วิธีการต่อไปนี้: การใช้โลหะผสมที่ทนต่อสารเคมี การปกป้องพื้นผิวของโลหะด้วยการเคลือบซึ่งส่วนใหญ่มักใช้โลหะที่เคลือบในอากาศด้วยฟิล์มออกไซด์ที่ทนทานต่อผลกระทบของสภาพแวดล้อมภายนอก การรักษาสภาพแวดล้อมที่มีฤทธิ์กัดกร่อน วิธีเคมีไฟฟ้า (การป้องกันแบบแคโทดิก วิธีป้องกัน)
ตัวอย่างการแก้ปัญหา
ตัวอย่างที่ 1
ตัวอย่างที่ 2
| ออกกำลังกาย | ส่วนประกอบประกอบด้วยโลหะผสมของเหล็กและนิกเกิล โลหะชนิดใดจะกัดกร่อนเร็วกว่า? เขียนสมการของกระบวนการขั้วบวกและขั้วลบระหว่างการกัดกร่อนในชั้นบรรยากาศ ค่าศักย์ไฟฟ้าของอิเล็กโทรดมาตรฐานคือ E(Fe 2+ /Fe) = - 0.444V, E(Ni 2+ /Ni) = -0.250V |
| สารละลาย | ประการแรกโลหะที่ใช้งานอยู่ (ที่มีค่าลบมากที่สุดของศักย์ไฟฟ้ามาตรฐาน) อาจเกิดการกัดกร่อนได้ ในกรณีนี้คือเหล็ก เป็นที่นิยมในหมวดหมู่:
|