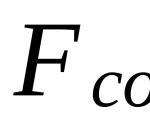De ce se determină polifosfații din apa potabilă? Fosfați hidrolizabili acizi în particule. A.8 Cerințe de calificare a operatorului
Fosfor general
Suma fosforului mineral și organic. La fel ca în cazul azotului, schimbul de fosfor între formele sale minerale și organice, pe de o parte, și organismele vii, pe de altă parte, este principalul factor care determină concentrația acestuia. Concentrația de fosfor total dizolvat (mineral și organic) în apele naturale nepoluate variază de la 5 la 200 μg/dm 3 .
Forme de fosfor în apele naturale
| Formele chimice ale fosforului | General | Filtrabil (dizolvat) | Particule |
| General | Fosfor total dizolvat | Fosfor total în particule | |
| Ortofosfați | Fosfor total dizolvat și suspendat | Ortofosfați dizolvați | Ortofosfați în particule |
| Fosfați hidrolizați acizi | Fosfați hidrolizabili acizi dizolvați și în suspensie totale | Fosfați acizi dizolvați hidrolizabili | Fosfați hidrolizabili acizi în particule |
| Fosfor organic | Fosfor organic total dizolvat și suspendat | Fosfor organic dizolvat | Fosfor organic în particule |
Fosforul este cel mai important element biogen, cel mai adesea limitând dezvoltarea productivității corpurilor de apă. Prin urmare, furnizarea de compuși ai fosforului în exces din zona de captare (sub formă îngrășăminte minerale cu scurgeri de suprafață din câmpuri (se realizează 0,4-0,6 kg de fosfor la hectar de teren irigat), cu scurgeri de la ferme (0,01-0,05 kg/zi pe animal), cu deșeuri menajere netratate sau netratate. ape uzate(0,003-0,006 kg/zi pe locuitor), precum și cu unele deșeuri industriale, duce la o creștere bruscă necontrolată a biomasei vegetale a unui corp de apă (acest lucru este tipic mai ales pentru corpurile de apă stagnante și cu debit scăzut). Are loc o așa-numită schimbare a stării trofice a rezervorului, însoțită de o restructurare a întregii comunități acvatice și care duce la predominarea proceselor putrefactive (și, în consecință, la creșterea turbidității, a salinității și a concentrației bacteriene). Un aspect probabil al procesului de eutrofizare este creșterea algelor albastre-verzi (cianobacterii), dintre care multe sunt toxice. Substanțele eliberate de aceste organisme aparțin grupului de compuși organici care conțin fosfor și sulf (otrăvuri pentru nervi). Efectul toxinelor algelor albastre-verzi se poate manifesta prin apariția dermatozelor și a bolilor gastrointestinale; în cazuri deosebit de severe, când o masă mare de alge pătrunde în interiorul corpului, se poate dezvolta paralizia. Conform cerințelor sistem global monitorizarea stării mediu Programele (GEMS) pentru observarea obligatorie a compoziției apelor naturale includ determinarea conținutului de fosfor total (dizolvat și în suspensie, sub formă de compuși organici și minerali). Fosforul este cel mai important indicator al stării trofice a corpurilor naturale de apă.
Fosfor organic
Această secțiune nu acoperă compușii organofosforici sintetizați industrial. Compușii naturali ai fosforului organic intră în apele naturale ca rezultat al proceselor vitale și al degradarii post-mortem a organismelor acvatice și schimbul cu sedimentele de fund. Compușii organici ai fosforului sunt prezenți în apele de suprafață în stări dizolvate, suspendate și coloidale.
Fosfor mineral
Conexiuni fosfor mineral pătrunde în apele naturale ca urmare a intemperiilor și dizolvării rocilor care conțin ortofosfați (apatite și fosforite) și a pătrunderii de la suprafața bazinului hidrografic sub formă de ioni orto-, meta-, piro- și polifosfat (îngrășăminte, sintetice). detergenti, aditivi care previn formarea calcarului în cazane etc.), și se formează și în timpul prelucrării biologice a reziduurilor animale și organisme vegetale. Conținutul excesiv de fosfat în apă, în special în apele subterane, poate fi o reflectare a prezenței impurităților de îngrășăminte, a componentelor apelor uzate menajere și a biomasei în descompunere în corpul de apă. Principala formă de fosfor anorganic la valori ale pH-ului rezervorului mai mari de 6,5 este ionul HPO 4 2- (aproximativ 90%). În apele acide, fosforul anorganic este prezent în principal sub formă de H 2 PO 4 - . Concentrația de fosfați în apele naturale este de obicei foarte scăzută - sutimi, rar zecimi de miligrame pe litru în apele poluate poate ajunge la câteva miligrame la 1 dm 3; Apele subterane conțin de obicei nu mai mult de 100 μg/dm 3 fosfați; Excepția este apa din zonele în care apar roci care conțin fosfor. Conținutul de compuși ai fosforului este supus unor fluctuații sezoniere semnificative, deoarece depinde de raportul dintre intensitatea proceselor de fotosinteză și oxidarea biochimică a substanțelor organice. Concentrațiile minime de fosfați în apele de suprafață se observă de obicei primăvara și vara, maximele - toamna și iarna, în ape marii- respectiv primavara si toamna, vara si iarna. Efectul toxic general al sărurilor acidului fosforic este posibil numai la doze foarte mari și se datorează cel mai adesea impurităților de fluor. În metodologia de evaluare situatia ecologica, adoptat de Comitetul de Stat pentru Ecologie al Federației Ruse, standardul recomandat pentru conținutul de fosfați solubili în apă este de 50 μg/dm 3 . Fără pregătirea preliminară a probei, fosfații anorganici dizolvați și în suspensie sunt determinați colorimetric.
Polifosfați
Barbati (PO 3) n , Barbati+2 P n O 3n+1 , Barbati H 2 P n O 3n+1
Folosit pentru dedurizarea apei, degresarea fibrelor, ca componentă a pudrelor de spălat și a săpunurilor, inhibitor de coroziune, catalizator etc. industria alimentară. Scăzut toxic. Toxicitatea se explică prin capacitatea polifosfaților de a forma complexe cu ioni importanți din punct de vedere biologic, în special calciu. Cantitatea reziduală admisă stabilită de polifosfați în apa de băut este de 3,5 mg/dm 3 (indicatorul limitativ al daunelor este organoleptic).
Compuși ai sulfului
Hidrogen sulfurat și sulfuri.
De obicei, hidrogenul sulfurat nu este conținut în ape sau este prezent în cantități nesemnificative în straturile inferioare, în principal în perioada de iarna când aerarea și amestecarea vântului a maselor de apă sunt dificile. Uneori, hidrogenul sulfurat apare în cantități vizibile în straturile inferioare ale rezervoarelor și vara în perioadele de oxidare biochimică intensă a substanțelor organice. Prezența hidrogenului sulfurat în ape este un indicator al poluării severe a rezervorului cu substanțe organice. Hidrogenul sulfurat în apele naturale se găsește sub formă de molecule de H 2 S nedisociate, ioni de hidrosulfură HS și, foarte rar, ioni de S 2- sulfură. Relația dintre concentrațiile acestor forme este determinată de valorile pH-ului apei: la pH< 10 содержанием ионов сульфида можно пренебречь, при рН=7 содержание H 2 S и HS - примерно одинаково, при рН=4 сероводород почти полностью (99,8%) находится в виде H 2 S. Главным источником сероводорода и сульфидов в поверхностных водах являются восстановительные процессы, протекающие при бактериальном разложении и биохимическом окислении органических веществ естественного происхождения и веществ, поступающих в водоем со сточными водами (хозяйственно-бытовыми, предприятий пищевой, металлургической, химической промышленности, производства сульфатной целлюлозы (0,01-0,014 мг/дм 3) и др.). Особенно интенсивно процессы восстановления происходят в подземных водах и придонных слоях водоемов в условиях слабого перемешивания и дефицита кислорода. Значительные количества сероводорода и сульфидов могут поступать со сточными водами нефтеперерабатывающих заводов, с городскими сточными водами, водами производств минеральных удобрений. Концентрация сероводорода в водах быстро уменьшается за счет окисления кислородом, растворенным в воде, и микробактериологических процессов (тионовыми, бесцветными и окрашенными серными бактериями). В процессе окисления сероводорода образуются сера и сульфаты. Интенсивность процессов окисления сероводорода может достигать 0,5 грамм сероводорода на литр в сутки. Причиной ограничения концентраций в воде является высокая токсичность сероводорода, а также неприятный запах, который резко ухудшает органолептические свойства воды, делая ее непригодной для питьевого водоснабжения и других технических и хозяйственных целей. Появление сероводорода в придонных слоях служит признаком острого дефицита кислорода и развития заморных явлений , . Для водоемов санитарно-бытового и рыбохозяйственного пользования наличие сероводорода и сульфидов недопустимо (ПДК - полное отсутствие) .
Sulfati
Sunt prezenți în aproape toate apele de suprafață și sunt unul dintre cei mai importanți anioni. Principala sursă de sulfați în apele de suprafață sunt procesele de intemperii chimice și dizolvarea mineralelor care conțin sulf, în principal gips, precum și oxidarea sulfurilor și a sulfului:
2FeS2 + 7O2 + 2H2O = 2FeS04 + 2H2SO4;
2S + 3O2 + 2H2O = 2H2SO4.
Cantități semnificative de sulfați pătrund în corpurile de apă în procesul de moarte a organismelor și de oxidare a substanțelor terestre și acvatice de origine vegetală și animală și cu scurgere subterană. Sulfații se găsesc în cantități mari în apele de mină și în apele uzate industriale din industriile care utilizează acid sulfuric, de exemplu, oxidarea piritei. Sulfații se realizează și cu apele uzate din serviciile municipale și producția agricolă. Forma ionică SO 4 2- este caracteristică numai apelor slab mineralizate. Odată cu creșterea mineralizării, ionii sulfat tind să formeze perechi neutre asociate stabile, cum ar fi CaSO4, MgSO4. Conținutul de ioni de sulfat în soluție este limitat de solubilitatea relativ scăzută a sulfatului de calciu (produs de solubilitate a sulfatului de calciu L=6,1·10 -5). La concentrații scăzute de calciu, precum și în prezența sărurilor străine, concentrația de sulfați poate crește semnificativ. Sulfații participă activ la ciclul complex al sulfului. În absența oxigenului, sub acțiunea bacteriilor sulfato-reducătoare, acestea sunt reduse la hidrogen sulfurat și sulfuri, care, atunci când apare oxigenul în apa naturală, se oxidează din nou la sulfați. Plantele și alte organisme autotrofe extrag sulfații dizolvați în apă pentru a construi substanțe proteice. După ce celulele vii mor, bacteriile heterotrofe eliberează sulf proteic sub formă de hidrogen sulfurat, care este ușor oxidat la sulfați în prezența oxigenului. Concentrația de sulfați în apa naturală variază foarte mult. În apele râurilor și în apele proaspete ale lacurilor, conținutul de sulfați variază adesea de la 5-10 la 60 mg/dm3, în apele de ploaie - de la 1 la 10 mg/dm3. În apele subterane, conținutul de sulfați atinge adesea valori semnificativ mai mari. Concentrația de sulfați în apele de suprafață este supusă unor fluctuații sezoniere marcate și, de obicei, se corelează cu modificări ale salinității generale a apei. Cel mai important factor, care determină regimul sulfatului, sunt relațiile schimbătoare dintre scurgerea de suprafață și cea subterană. O influență notabilă o exercită procesele redox, situația biologică din corpul de apă și activitate economică persoană Conținutul crescut de sulfați înrăutățește proprietățile organoleptice ale apei și au un efect fiziologic asupra organismului uman. Deoarece sulfatul are proprietăți laxative, concentrația sa maximă admisă este strict reglementată reglementărilor. Apelor care alimentează centralele cu abur sunt impuse cerințe foarte stricte pentru conținutul de sulfați, deoarece în prezența calciului, sulfații formează o scară puternică. Pragul de gust pentru sulfatul de magneziu variază de la 400 la 600 mg/dm 3 , pentru sulfatul de calciu - de la 250 la 800 mg/dm 3 . Prezența sulfatului în industria și apă potabilă poate fi atât util, cât și dăunător. Concentrația maximă admisă pentru sulfați este de 500 mg/dm 3, concentrația maximă admisă pentru vr este de 100 mg/dm 3. Nu s-a observat că sulfatul din apa potabilă afectează procesele de coroziune, dar dacă se folosesc conducte de plumb, atunci concentrația de sulfați peste 200 mg/dm 3 poate duce la scurgerea plumbului în apă.
Disulfură de carbon
Lichid volatil transparent cu miros înțepător. Poate fi eliberat în cantități mari în corpurile de apă deschise cu apele uzate de la fabricile de mătase de viscoză, fabricile de piele artificială și o serie de alte industrii. Când conținutul de disulfură de carbon este de 30-40 mg/dm 3, se observă un efect inhibitor asupra dezvoltării microflorei saprofite. Concentrația maximă care nu are efect toxic asupra peștilor este de 100 mg/dm3. Disulfura de carbon este o otravă politropică care provoacă intoxicație acută și cronică. Afectează sistemul nervos central și periferic, provocând tulburări ale sistemului cardiovascular. Are un efect dăunător asupra tractului gastro-intestinal. Perturbează metabolismul vitaminei B6 și acidului nicotinic. MAC v - 1,0 mg/dm 3 (indicator limitator de vătămare - organoleptic), MAC vr - 1,0 mg/dm 3 (indicator limitator de vătămare - toxicologic), .
Apă potabilă. Metodă de determinare a conținutului de polifosfat
Data introducerii 01.01.74
Acest standard se aplică apei potabile și specifică o metodă colorimetrică pentru determinarea polifosfaților.
Metoda se bazează pe hidroliza polifosfaților în mediu acid, în timpul căreia aceștia se transformă în ortofosfați dizolvați, determinati prin metoda colorimetrică sub formă de complex de fosfomolibden, colorat în albastru. Într-o probă separată, se determină ortofosfații care au fost inițial în apă, al căror conținut se scade din rezultatul obținut la determinarea polifosfaților. Sensibilitatea metodei este de 0,01 mg/dm 3 .
. METODE DE PRELEVARE
** Pe site-ul Federația Rusă GOST R 51593-2000 este valabil.
2. ECHIPAMENTE, MATERIALE, REACTIVI
Colorimetru fotoelectric, cuve cu grosimea stratului de lucru de 2 - 3 cm.
Termostat cu regulator de temperatura.
Aragaz electric.
Filtru de hârtie (bandă albastră).
Sticlă de laborator de măsurare în conformitate cu GOST 1770, GOST 29227 și GOST 29169 cu capacitate: baloane cotate 50, 100 și 1000 cm 3, pipete de măsurare 1 - 2 cm 3 cu diviziuni 0,01 cm 3, 5 - 10 cm 3 01 cm 3. ; pipete de 5, 10, 20, 50 și 100 cm 3 fără diviziuni.
Pahare de sticlă de laborator conform GOST 25336.
Acid molibdat de amoniu conform GOST 3765.
Fosfat de potasiu monosubstituit conform GOST 4198.
Diclorura de staniu conform TU 6-09-5384.
Acid sulfamic.
Apă distilată conform GOST 6709.
Toate ustensilele trebuie tratate cu acid clorhidric fierbinte și spălate bine cu apă distilată.
Toți reactivii trebuie să fie de calitate analitică.
. PREGĂTIREA PENTRU ANALIZĂ
3.1 . Prepararea unei soluții standard bazice de fosfat de potasiu monosubstituit.
0 .7165 g KH 2 PO 4 , X. ore, uscate în prealabil într-un termostat timp de 2 ore la 105 °C, se dizolvă într-un balon cotat de 1000 cm 3 cu apă distilată și se ajustează volumul soluției la semn, se adaugă 2 cm 3 de cloroform. Soluția de 1 cm 3 conține 0,5 mg
3.2 . Prepararea primei soluții standard de lucru de fosfat de potasiu monosubstituit.
10 cm 3 din soluția principală se ajustează la 1 dm 3 cu apă distilată, 1 cm 3 din soluție conține 0,005 mg.
3.3 . Prepararea celei de-a doua soluții standard de lucru de fosfat de potasiu monosubstituit.
50 cm 3 I soluția de lucru se ajustează la 250 cm 3 cu apă distilată. 1 cm 3 de soluție conține 0,001 mg.
Este necesar să utilizați o soluție proaspăt preparată.
3.4 . Prepararea molibdatului de amoniu (reactiv I, soluție acidă)
25 g (NH4)6Mo7 O 24 · 4H 2 O se dizolvă în 600 cm 3 de apă distilată. La această soluție, cu grijă, în timp ce se răcește, se adaugă 337 cm 3 de acid sulfuric concentrat 98%. După răcire, soluţia se aduce la 1 dm 3 cu apă distilată. Soluția se păstrează într-o sticlă de sticlă închisă la culoare, cu dop măcinat. Reactivul poate fi utilizat la 48 de ore după preparare.
3.5 . Prepararea molibdatului de amoniu (reactiv II, soluție ușor acidă)
10 g (NH4 ) 6 Mo 7 O 24 · 4H 2 O se dizolvă în 400 cm 3 de apă distilată şi se adaugă 7 cm 3 de acid sulfuric concentrat 98%. Soluția se păstrează într-o sticlă de plastic într-un loc întunecat. Stabil timp de aproximativ 3 luni. Reactivul poate fi utilizat la 48 de ore după preparare.
3.6 . Prepararea unei soluții de acid sulfuric 37%.
337 cm 3 de acid sulfuric concentrat 98% se amestecă cu grijă adăugând porții mici la 600 cm 3 de apă distilată. După răcire, soluţia se aduce la 1 dm 3 cu apă distilată.
3.7 . Prepararea unei soluții stoc de clorură stanoasă
1 .95 g SnCl cristalin neintemperat 2 · 2H2O se dizolvă în 50 cm3 acid clorhidric 13,6% (18,4 cm3 HCI 37% fără arsenic, ajustat la 50 cm3 cu apă distilată). Suspensia este bine amestecată și depozitată într-o sticlă acoperită în interior cu un strat de parafină. Suspensia se amestecă bine înainte de utilizare. Suspensia poate fi utilizată direct după preparare.
3.8 . Prepararea soluției de lucru de clorură stanoasă
2 .5 cm 3 din soluţia principală (suspensie) se aduce la 10 cm 3 cu apă distilată.
Este necesar să utilizați o soluție proaspăt preparată. Soluția este stabilă timp de aproximativ 4 ore.
. EFECTUAREA ANALIZEI
4.1 . Determinarea este interferată de fier la concentrații care depășesc 1 mg/dm 3 , silicații solubili care depășesc 25 mg/dm 3 și nitriți. Influența fierului și a silicaților este eliminată prin diluarea corespunzătoare a apei de testare. Efectul nitriților la concentrații de până la 25 mg/dm 3 este eliminat prin adăugarea a 0,1 g de acid sulfamic NH la probă 2 SO 2 OH, care este adăugat înainte ca molibdatul de amoniu să fie adăugat la probă.
4.2 . Determinarea ortofosfaților
La 50 cm 3 de apă de testare (fără diluare, nu se poate determina mai mult de 0,4 mg/dm 3 )), filtrat printr-un filtru de hârtie groasă cu bandă albastră, se adaugă aceiași reactivi și în aceeași ordine ca în soluțiile de probă. Densitatea optică a soluției este determinată de un electrofotocolorimetru. Concentrația ortofosfaților este setată în funcție de curba de calibrare.
4.3 . Determinarea polifosfaților
La 100 cm3 din apa de testare, filtrată printr-un filtru de hârtie groasă, sau la un volum mai mic adus la 100 cm3 cu apă distilată, se adaugă 2 cm3 dintr-o soluție de acid sulfuric 37% și se fierbe timp de 30 de minute. Volumul de apă testat este menținut prin adăugarea de apă distilată în intervalul 50-90 cm3. După răcirea soluției, se transferă într-un balon cotat de 100 cm 3 și se ajustează volumul la semn cu apă distilată. Se adaugă 1 cm 3 dintr-o soluție slab acidă de soluție de acid molibdic (reactiv II), se amestecă și după 5 minute se adaugă 0,1 cm 3 dintr-o soluție de lucru de diclorură de staniu, apoi se amestecă din nou. După 10 - 15 minute, măsurați intensitatea culorii cu un electrofotocolorimetru.
4.4 . Construirea unui grafic de calibrare
Se pipetează 0,0 în baloane cotate cu o capacitate de 50 cm 3; 0,5; 1,0; 2,0; 5,0; 10,0; 20,0 cm 3 soluție standard de lucru de fosfat de potasiu (1 cm 3 - 0,001 mg) și aduceți volumul soluției la semn cu apă distilată. Conținutul de polifosfați din soluțiile de probă va fi respectiv: 0,0; 0,01; 0,02; 0,04; 0,10; 0,20; 0,40 mgîn 1 dm 3 apă. Se adaugă exact 1 cm 3 de molibdat de amoniu (reactiv I, soluție acidă) în fiecare balon, se amestecă și după 5 minute se adaugă 0,1 cm 3 dintr-o soluție de lucru de diclorură de staniu cu ajutorul unei micropipete și se amestecă. Intensitatea culorii se măsoară după 10 - 15 minute cu un colorimetru fotoelectric folosind un filtru roșu ( l = 690 - 720 nm) și cuve cu grosimea stratului de 2 - 3 cm Din densitățile optice obținute se scade densitatea optică a probei de control și se trasează rezultatele.
. REZULTATELE PRELUCRĂRII
5.1 . Conținutul de ortofosfați anorganici dizolvați (X), mg/dm 3, determinat prin formula
Unde C- continutul de ortofosfati, constatat din graficul de calibrare, mg/cm 3 ;
50 - aducerea volumului de apă studiat la 50 cm 3 ;
V - volumul de apă de testare prelevat pentru determinare, cm 3.
5.2 . Conținutul de polifosfați hidrolizabili (X 1 ), mg/dm 3, determinat prin formula
![]()
Unde CU 1 - conţinutul de polifosfat găsit din graficul de calibrare, mg/dm 3 ;
100 - aducerea volumului de apă studiat la 100 cm 3 ;
V - volumul de apă de testare prelevat pentru determinare, cm 3.
Discrepanța admisă între determinările repetate de polifosfați este de 0,01 mg/dm 3, dacă conținutul acestora nu depășește 0,07 mg/dm 3, cu un conținut mai mare - 15% rel.